Soal 1
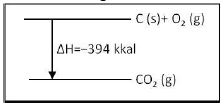
Perhatikan diagram reaksi dari pembentukan CO2 dari unsur unsurnya.
Dari diagram diatas, kalor pembentukan CO adalah . . . .
Soal 2
Perhatikan diagram reaksi dari pembentukan CO2 dari unsur - unsurnya:
perubahan entalpi pada pembentukan 1 mol CO2 dari CO adalah. . . . .
A. -26,4 kkal
B. +26,4 kkal
C. -67,7 kkal
D. +67,7 kkal
E. -94,1 kkal
Soal 3
perhatikan diagram di bawah ini :
Pernyataan yang tidak benar berdasarkan diagram diatas adalah . . . .
A. Besarnya entalpi pembakaran karbon = - 394 kJ/mol
B. Besarnya entalpi pembentukan CO2 = -394 kJ/mol
C. Besarnya entalpi pemebentukan CO2 = -394 kJ/mol
D. pada pembakaran sempurna 12 gram karbon diperlukan kalor sebanyak 394 kJ
E. Pada pembentukkan 22,4 L (STP) gas CO2 dari unsur-unsurnya dihasilkan kalor sebesar 394
kJ
kJ
Soal 4
Perhatikan diagram tingkat energi reaksi karbon dengan oksigen membentuk CO2 !
Kalor pembentuk CO adalah….
A. −222 kJ/mol
B. −111 kJ/mol
C. +111 kJ/mol
D. +222 kJ/mol
E. +333 kJ/mol
B. −111 kJ/mol
C. +111 kJ/mol
D. +222 kJ/mol
E. +333 kJ/mol
Soal 5
Perhatikan grafik di bawah ini !
Dari grafik di atas, kalor pembentukkan CO adalah….
A. ΔH2 = ΔH3 – ΔH1
B. ΔH2 = ΔH1 – ΔH3
C. ΔH2 = ΔH3 + ΔH1
D. ΔH2 = ⅓ (ΔH1 – ΔH3)
E. ΔH2 = ½ (ΔH1 – ΔH3)
B. ΔH2 = ΔH1 – ΔH3
C. ΔH2 = ΔH3 + ΔH1
D. ΔH2 = ⅓ (ΔH1 – ΔH3)
E. ΔH2 = ½ (ΔH1 – ΔH3)
Soal 6
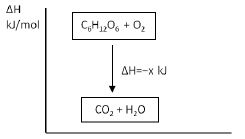
Diagram entalpi reaksi pembakaran glukosa sebagai berikut.
Berdasarkan diagram tersebut, reaksi yang terjadi adalah….
A. Eksoterm karena terjadi perpindahan energi dari lingkungan ke sistem
B. Eksoterm karena terjadi perpindahan energi dari system ke lingkungan
C. Endoterm karena terjadi perpindahan energi dari sistem ke lingkungan
D. Endoterm karena terjadi perpindahan energi dari lingkungan ke sistem
E. Eksoterm karena tidak terjadi perpindahan energi dari sistem ke lingkungan
A. Eksoterm karena terjadi perpindahan energi dari lingkungan ke sistem
B. Eksoterm karena terjadi perpindahan energi dari system ke lingkungan
C. Endoterm karena terjadi perpindahan energi dari sistem ke lingkungan
D. Endoterm karena terjadi perpindahan energi dari lingkungan ke sistem
E. Eksoterm karena tidak terjadi perpindahan energi dari sistem ke lingkungan
Soal 7
Untuk membentuk 1 mol NH4Cl dari unsur-unsurnya diperlukan energi 314,4 kJ. Diagram tingkat
energi berikut yang sesuai adalah….
energi berikut yang sesuai adalah….
Soal 8
Perhatikan diagram tingkat energi berikut.
Pernyataan yang tepat mengenai reaksi pembentukan etanol tersebut adalah….
A. Reaksi endoterm, karena ΔH produk < ΔH reaktan
B. Reaksi eksoterm, karena menyerap kalor sebesar 12,07 kJ
C. Reaksi endoterm, karena ΔH produk > ΔH reaktan
D. Reaksi endoterm, karena melepaskan kalor sebesar 12,07 kJ
E. Reaksi eksoterm, karena melepaskan kalor sebesar 12,07 kJ
B. Reaksi eksoterm, karena menyerap kalor sebesar 12,07 kJ
C. Reaksi endoterm, karena ΔH produk > ΔH reaktan
D. Reaksi endoterm, karena melepaskan kalor sebesar 12,07 kJ
E. Reaksi eksoterm, karena melepaskan kalor sebesar 12,07 kJ
Soal 9
Reaksi adisi adalah reaksi yang terjadi pemutusan ikatan rangkap. Data perubahan entalpi pada
reaksi adisi propena dengan asam klorida sebagai berikut:
CH2 = CH – CH3 + HCl → CH2 – CH – CH3 ΔH = − 49 kJ/mol
| |
H Cl
Jika diketahui energi ikatan rata-rata:
C = C : 609 kJ/mol C – C : 348 kJ/mol
C – H : 413 kJ/mol H – Cl : 431 kJ/mol
Maka besarnya energi ikatan rata-rata C – Cl adalah….
A. 43 kJ/mol
B. 328 kJ/mol
C. 442 kJ/mol
D. 710 kJ/mol
E. 873 kJ/mol
reaksi adisi propena dengan asam klorida sebagai berikut:
CH2 = CH – CH3 + HCl → CH2 – CH – CH3 ΔH = − 49 kJ/mol
| |
H Cl
Jika diketahui energi ikatan rata-rata:
C = C : 609 kJ/mol C – C : 348 kJ/mol
C – H : 413 kJ/mol H – Cl : 431 kJ/mol
Maka besarnya energi ikatan rata-rata C – Cl adalah….
A. 43 kJ/mol
B. 328 kJ/mol
C. 442 kJ/mol
D. 710 kJ/mol
E. 873 kJ/mol
Soal 10
Ke dalam 50 cm3 larutan HCl 1 M direaksikan dengan 50 cm3 NaOH 0,6 M, suhu awal larutan
27 oC dan setelah dicampurkan 32 oC. Jika kalor jenis 4,2 Jg−1K−1, maka perubahan entalpi reaksi
penetralan tersebut adalah….
A. – 35 kJ
B. – 12,5 kJ
C. + 35 kJ
D. – 70 kJ
E. + 70 kJ
27 oC dan setelah dicampurkan 32 oC. Jika kalor jenis 4,2 Jg−1K−1, maka perubahan entalpi reaksi
penetralan tersebut adalah….
A. – 35 kJ
B. – 12,5 kJ
C. + 35 kJ
D. – 70 kJ
E. + 70 kJ
Soal 11
Diketahui:
ΔHfo TiCl4 (g) = − 763 kJ/mol
ΔHfo H2O (l) = − 286 kJ/mol
ΔHfo TiO2 (g) = − 945 kJ/mol
ΔHfo HCl (g) = − 92 kJ/mol
Besarnya perubahan entalpi reaksi (ΔH) untuk reaksi:
TiCl4 (g) + 2H2O (l) → TiO2 (g) + 4HCl (g) , adalah….
A. 12 kJ
B. – 264 kJ
C. 298 kJ
D. 22 kJ
E. 18 kJ
ΔHfo TiCl4 (g) = − 763 kJ/mol
ΔHfo H2O (l) = − 286 kJ/mol
ΔHfo TiO2 (g) = − 945 kJ/mol
ΔHfo HCl (g) = − 92 kJ/mol
Besarnya perubahan entalpi reaksi (ΔH) untuk reaksi:
TiCl4 (g) + 2H2O (l) → TiO2 (g) + 4HCl (g) , adalah….
A. 12 kJ
B. – 264 kJ
C. 298 kJ
D. 22 kJ
E. 18 kJ
Soal 12
Diketahui:
H2O (l) → H2 (g) + O2 (g) ΔH = +68,3 kkal
H2 (g) + ½O2 (g) → H2O (g) ΔH = −57,8 kkal
H2O (l)→ H2O (g) ΔH = −1,4 kkal
Besarnya perubahan entalpi es menjadi uap air adalah….
A. −11,9 kkal
B. − 9,1 kkal
C. + 9,1 kkal
D. +11,9 kkal
E. +124,7 kkal
H2O (l) → H2 (g) + O2 (g) ΔH = +68,3 kkal
H2 (g) + ½O2 (g) → H2O (g) ΔH = −57,8 kkal
H2O (l)→ H2O (g) ΔH = −1,4 kkal
Besarnya perubahan entalpi es menjadi uap air adalah….
A. −11,9 kkal
B. − 9,1 kkal
C. + 9,1 kkal
D. +11,9 kkal
E. +124,7 kkal
Soal 13
Karbon dan gas monoksida bereaksi dengan gas oksigen menghasilkan gas karbon dioksida
menurut persamaan:
C (s) + O2 (g) → CO2 (g) ΔH = −394 kJ/mol
2CO (g) + O2 (g) → 2CO2 ΔH = −569 kJ/mol
Kalor pembentukkan sempurna 1 mol gas karbon monoksida adalah….
A. −219,0 kJ
B. −109,5 kJ
C. −165,0 kJ
D. +109,5 kJ
E. +219,0 kJ
menurut persamaan:
C (s) + O2 (g) → CO2 (g) ΔH = −394 kJ/mol
2CO (g) + O2 (g) → 2CO2 ΔH = −569 kJ/mol
Kalor pembentukkan sempurna 1 mol gas karbon monoksida adalah….
A. −219,0 kJ
B. −109,5 kJ
C. −165,0 kJ
D. +109,5 kJ
E. +219,0 kJ
Soal 14
Pada pembakaran sempurna 1 mol gas metana (CH4) dibebaskan energi sebesar 100 kJ.
Jika diketahui:
C = O : 242 kJ/mol
O – H : 432 kJ/mol
O = O : 335 kJ/mol
Maka energi ikatan rata-rata C – H adalah….
A. 599,50 kJ/mol
B. 595,00 kJ/mol
C. 360,50 kJ/mol
D. 258,50 kJ/mol
E. 194,75 kJ/mol
Jika diketahui:
C = O : 242 kJ/mol
O – H : 432 kJ/mol
O = O : 335 kJ/mol
Maka energi ikatan rata-rata C – H adalah….
A. 599,50 kJ/mol
B. 595,00 kJ/mol
C. 360,50 kJ/mol
D. 258,50 kJ/mol
E. 194,75 kJ/mol
Soal 15
Jika diketahui perubahan entalpi untuk reaksi berikut:
2 Fe (s) + O2 (g) → Fe2O3 (s) ΔH = −822 kJ/mol
C (s) + ½ O2 (g) → CO (g) ΔH = −110 kJ/mol
Perubahan untuk reaksi:
3 C (s) + Fe2O3 (s) → 2 Fe (s) + 3 CO (g) adalah….
A. −932 kJ/mol
B. −712 kJ/mol
C. −492 kJ/mol
D. +492 kJ/mol
E. +712 kJ/mol
2 Fe (s) + O2 (g) → Fe2O3 (s) ΔH = −822 kJ/mol
C (s) + ½ O2 (g) → CO (g) ΔH = −110 kJ/mol
Perubahan untuk reaksi:
3 C (s) + Fe2O3 (s) → 2 Fe (s) + 3 CO (g) adalah….
A. −932 kJ/mol
B. −712 kJ/mol
C. −492 kJ/mol
D. +492 kJ/mol
E. +712 kJ/mol